Enzime
definiție
Enzimele sunt substanțe chimice care pot fi găsite pe tot corpul. Acestea pun în mișcare reacții chimice în corp.
istorie
Cuvantul enzimă a fost realizat de Wilhelm Friedrich Kühne 1878 și derivă din cuvântul grecesc alcătuit enzimon, care înseamnă drojdie sau aluat. Acest lucru și-a găsit apoi drumul în știința internațională. uniunea internațională a chimiei pure aplicate (IUPAC) si uniunea internațională a biochimiei (IUBMB) au lucrat împreună pentru a dezvolta o nomenclatură pentru enzime care definește reprezentanții acestui grup mare de substanțe ca un grup comun. Denumirea, care clasifică enzimele în funcție de sarcinile lor, este importantă pentru determinarea sarcinilor enzimelor individuale.
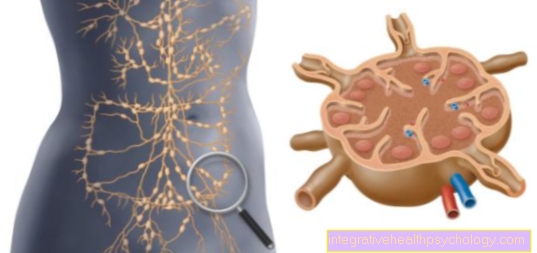
Ilustrarea enzimelor
Enzime
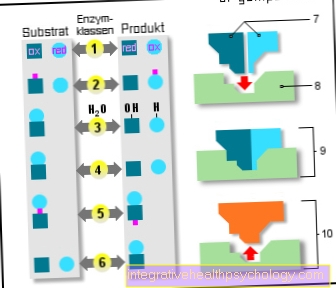
6 clase de enzime:
- Oxidoreductaze
(Reducerea de oxidare) - Transferaze
(Transmisie) - Hidrolaze
(Utilizarea apei) - Lyases
(Clivaj) - Izomeraze
(aceeași formulă empirică) - Ligazele
(Reacții de adăugare) - Substraturi
- Centru activ
- Enzimă / substrat
complex - Enzimă / produs
complex
O privire de ansamblu asupra tuturorImaginile lui Dr-Gumpert pot fi găsite la: ilustrații medicale
Denumire
Denumire enzima este activată trei principii de bază bazat. Numele enzimelor care se termină cu –ase descriu mai multe enzime dintr-un sistem. Numele enzimei în sine descrie reacția pe care enzima o pune în mișcare (catalizat). Numele enzimei este, de asemenea, o clasificare a enzimei. În plus, un sistem de cod care Sistem de numere CE, în care enzimele sunt fabricate sub un cod numeric patru numere poate fi găsit. Primul număr indică clasa enzimei. Listele tuturor enzimelor detectate asigură că codul enzimei specificat poate fi găsit mai rapid. Deși codurile se bazează pe proprietățile reacției pe care enzima o catalizează, în practică codurile numerice se dovedesc a fi dificile. Denumirile sistematice bazate pe regulile de mai sus sunt utilizate mai frecvent. Probleme cu nomenclatura apar, de exemplu, cu enzime care catalizează mai multe reacții. Prin urmare, există uneori mai multe nume pentru ei. Unele enzime au denumiri banale care nu indică faptul că substanța menționată este o enzimă. Deoarece numele au fost utilizate în mod tradițional, unele dintre ele au fost păstrate.
Clasificare în funcție de funcția enzimatică
Conform IUPAC și IUBMB, enzimele sunt împărțite în șase clase de enzime în funcție de reacția pe care au pus-o în mișcare:
- Oxidoreductaze
Oxidoreductazele pun în mișcare reacțiile redox. În această reacție chimică, electronii sunt transferați de la un partener de reacție la celălalt. O substanță eliberează electroni (oxidare) și o altă substanță acceptă electroni (reducere).
Formula pentru reacția catalizată este A ?? + B? A? + B ?.
Substanța A eliberează un electron (?) Și este oxidată, în timp ce substanța B absoarbe acest electron și este redusă. Acesta este motivul pentru care reacțiile redox sunt numite și reacții de reducere-oxidare.
Multe reacții metabolice sunt reacții redox. Oxigenazele transferă unul sau mai mulți atomi de oxigen pe substratul lor. - Transferaze
Transferazele transferă grupul funcțional de la un substrat la altul. Grupurile funcționale sunt grupări atomice din compuși organici care determină în mare măsură proprietățile substanței și comportamentul reacției. Compușii chimici care au aceleași grupuri funcționale sunt grupați în clase de substanțe datorită proprietăților lor similare. Grupurile funcționale vor fi împărțite în funcție de faptul dacă sunt sau nu heteroatomi. Heteroatomii sunt toți atomi din compușii organici care nu sunt nici carbon, nici hidrogen.
De exemplu: -OH -> grupare hidroxil (alcooli) - Hidrolaze
Hidrolazele împart legăturile în reacții reversibile folosind apă. Esteri, esteri, peptide, glicozide, anhidride acide sau legături C-C. Reacția de echilibru este: A-B + H2O? A-H + B-OH.
O enzimă care aparține grupului de hidrolaze este, de exemplu, alfa galactozidaza. - Lyases
Liasele, numite și sintaze, catalizează scindarea produselor complexe de pe substraturi simple, fără separarea ATP. Schema de reacție este A-B → A + B.
ATP este adenozin trifosfat și o nucleotidă, constând din trifosfatul nucleozidului adenozină (și ca atare un bloc de construcție bogat în energie al ARN-ului acidului nucleic). Cu toate acestea, ATP este în principal forma universală de energie disponibilă imediat în fiecare celulă și, în același timp, un regulator important al proceselor de furnizare a energiei. Dacă este necesar, ATP este resintetizat din alte depozite de energie (fosfat de creatină, glicogen, acizi grași). Molecula ATP este formată dintr-un reziduu de adenină, zahăr riboză și trei fosfați („To”) în legături esterice („) sau anhidridice („ Și „). - Izomeraze
Izomerazele accelerează conversia chimică a izomerilor. Izomeria este apariția a doi sau mai mulți compuși chimici cu exact aceiași atomi (aceeași formulă empirică) și greutăți moleculare, care, totuși, diferă în legătură sau dispunerea spațială a atomilor. Compușii corespunzători se numesc izomeri.
Acești izomeri diferă prin proprietățile lor chimice și / sau fizice, și adesea și prin proprietățile lor biochimice. Izomeria apare în primul rând cu compuși organici, dar și cu compuși de coordonare (anorganici). Izomeria este împărțită în diferite zone. - Ligazele
Ligazele catalizează formarea substanțelor care sunt chimic mai complexe decât substraturile utilizate, dar, spre deosebire de liazele, sunt eficiente enzimatic numai cu scindarea ATP. Prin urmare, formarea acestor substanțe necesită energie, care se obține prin divizarea ATP.
Unele enzime sunt capabile să catalizeze mai multe reacții, uneori foarte diferite. Dacă acesta este cazul, acestea sunt alocate mai multor clase de enzime.
S-ar putea să vă intereseze și aceste articole:
- Alfa-glucozidaza
- Lipaza
- Tripsină
Clasificare în funcție de structura enzimei
Aproape toate enzimele sunt proteine și pot fi clasificate pe baza lungimii lanțului proteic:
- Monomeri
Enzime care constau dintr-un singur lanț proteic - Oligomeri
Enzime care constau din mai multe lanțuri proteice (monomeri) - Lanțuri multi-enzimatice
Mai multe enzime agregate care cooperează și se reglează reciproc. Aceste lanțuri enzimatice catalizează etapele succesive în metabolismul celulei.
În plus, există lanțuri de proteine individuale care conțin mai multe activități enzimatice; acestea sunt denumite enzime multifuncționale.
Clasificare în funcție de cofactori
O altă clasificare este clasificarea în funcție de considerația cofactorilor. Cofactorii, coenzimele și co-substraturile sunt denumiri pentru diferite clasificări ale substanțelor care influențează reacțiile biochimice prin interacțiunea lor cu enzimele.
Se consideră molecule organice și ioni (în mare parte ioni metalici).
Enzimele proteice pure sunt formate exclusiv din proteine, iar centrul activ este format numai din reziduuri de aminoacizi și coloana vertebrală a peptidei. Aminoacizii sunt o clasă de compuși organici cu cel puțin o grupă carboxi (-COOH) și o grupă amino (-NH2).
Holoenzimele constau dintr-o componentă proteică, apoenzima și un cofactor, o moleculă cu greutate moleculară mică (nu o proteină). Ambele împreună sunt importante pentru funcția enzimei.
Coenzime
Moleculele organice ca cofactori se numesc coenzime. Dacă sunt legați covalent de apoenzimă, ei se numesc grupuri protetice sau co-substraturi. O grupă protetică se referă la componentele non-proteice legate ferm (în cea mai mare parte covalent) de o proteină cu efect catalitic.
Cosubstratele sunt denumiri pentru diferite clasificări ale substanțelor care influențează reacțiile biochimice prin interacțiunea lor cu enzimele. Ca biocatalizatori, moleculele accelerează reacțiile din organisme, enzimele accelerează reacțiile biochimice. Acestea reduc energia de activare care trebuie depășită, astfel încât substanța să poată fi convertită.